Sử dụng khí ammoniac
Việc sử dụng chính của amoniac là phân phân bón . Nó thường được trực tiếp vào đất từ các bể chứa khí hoá lỏng. Amoniac có thể được áp dụng trực tiếp hoặc dưới dạng các muối amoni, chẳng hạn như ammonium nitrate , NH 4 NO 3, ammonium sulfate , (NH 4) 2 SO 4, và amoni nhiều phốt phát . Urea , (H 2 N) 2 C = O, cũng được sử dụng như là một nguồn nitơ cho phân bón . Amoniac cũng được sử dụng trong sản xuất thương mại chất nổ (ví dụ, trinitrotoluene (TNT), nitroglycerin , và nitrocellulose ).
Trong ngành công nghiệp dệt may, amoniac được sử dụng trong việc sản xuất sợi tổng hợp, chẳng hạn như nylon và tơ nhân tạo . Ngoài ra, nó được sử dụng trong nhuộm và tẩy sạch các cotton , len và lụa . Amoniac được dùng như một chất xúc tác trong sản xuất của một số tổng hợp nhựa .
Quan trọng hơn, nó sẽ trung hòa tính axit của các sản phẩm của lọc dầu , và trong cao su công nghiệp nó ngăn cản sự đông nguyên liệu trong quá trình vận chuyển từ rừng đến nhà máy. Amoniac cũng tìm thấy ứng dụng trong cả quá trình amoniac-nước ngọt (còn gọi là quá trình Solvay), một phương pháp được sử dụng rộng rãi để sản xuất soda, và quá trình Ostwald, một phương pháp chuyển đổi amoniac thành axit nitric .
Khí Amoniacđược sử dụng trong nhiều quy trình luyện kim
. Ngoài ra, ammonia có thể hấp thụ một lượng đáng kể nhiệt từ môi trường xung quanh của nó (ví dụ, một gram ammonia hấp thụ 327 calo nhiệt), mà làm cho nó hữu ích như một chất làm mát trong tủ lạnh và điều hòa không khí thiết bị.
Phát hiện và sản xuất khí amoniac
Amoniac tinh khiết được chuẩn bị bởi nhà khoa học vật lý Anh Joseph Priestley vào năm 1774, và thành phần chính xác của nó được xác định bởi nhà hóa học người Pháp Claude-Louis Berthollet trong 1785. Amoniac là luôn nằm trong số năm hóa chất hàng đầu sản xuất tại Hoa Kỳ . Các giám đốc thương mại của phương pháp sản xuất amoniac là do Quá trình Haber-Bosch , trong đó bao gồm các phản ứng trực tiếp của hydro nguyên tố và phân tử nitơ. N 2 + 3H 2 2NH 3 →
Phản ứng này đòi hỏi việc sử dụng một chất xúc tác , cao áp (100-1,000 atm) và nhiệt độ cao (400-550 ° C [750-1020 ° F]). Trên thực tế, sự cân bằng giữa các yếu tố và ammonia ủng hộ sự hình thành của ammonia ở nhiệt độ thấp, nhưng nhiệt độ cao là cần thiết để đạt được một tỷ lệ thỏa đáng về sự hình thành amoniac. Một số chất xúc tác khác nhau có thể được sử dụng. Thông thường các chất xúc tác là sắt có chứa sắt oxit . Tuy nhiên, cả hai magiê oxit nhôm oxit đã được kích hoạt bằng kim loại kiềm oxit và ruthenium trên carbon đã được sử dụng làm chất xúc tác. Trong phòng thí nghiệm, amoniac là tốt nhất tổng hợp bằng cách thủy phân của một kim loại nitride . Mg 3 N 2 + 6H 2 O → 2NH 3 + 3mg (OH) 2
Tính chất vật lý của khí amoniac
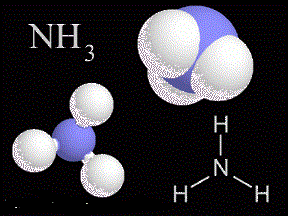
Khí Amoniac (NH 3) là chất khí không màu, mùi khai và sốc, nhẹ hơn không khí
điểm sôi là -33,35 ° C (-28,03 ° F), và nó điểm đông là -77,7 ° C (-107,8 ° F). Nó có nhiệt độ bay hơi (23,3 kJ mỗi ở điểm sôi của nó) và có thể được xử lý như một chất lỏng trong các thùng chứa cách nhiệt trong phòng thí nghiệm. (Nhiệt bay hơi của một chất là số lượng calo cần thiết để làm bốc hơi một mol của các chất không có thay đổi về nhiệt độ.) Các phân tử amoniac có một hình chóp tam giác hình dạng với ba nguyên tử hydro và một cặp không chia sẻ của các điện tử gắn với nguyên tử nitơ. Nó là một phân tử phân cực và được đánh giá cao vì có liên quan mạnh mẽ liên kết hydro giữa các phân tử. Các hằng số điện môi của amoniac (22 tại -34 ° C [-29 ° F]) là thấp hơn so với các nước (81 ở 25 ° C [77 ° F]), vì vậy nó là một tốt hơn dung môi cho các chất hữu cơ. Tuy nhiên, nó vẫn đủ cao để cho phép ammonia để hoạt động như một dung môi ion hóa tương đối tốt. Amoniac cũng tự ion hóa , mặc dù ít hơn so với làm nước 2NH 3 ⇌ NH 4+ + NH2
CÔNG TY TNHH VẠN TẤN PHÁT CHUYÊN CUNG CẤP KHÍ NH3 ĐẢM BẢO CHẤT LƯỢNG, GIÁ CẠNH TRANH, DỊCH VỤ UY TÍN VÀ GIAO HÀNG TẬN NƠI TOÀN QUỐC